El SarsCov2 ahonda las diferencias entre hombres y mujeres
Universidad Católica de Santiago de Guayaquil
Un estudio liderado por la Universidad de Yale estableció que las mujeres podrían desarrollar una respuesta inmune más fuerte que los hombres frente al coronavirus. Esta conclusión es el resultado de un análisis de cómo el sistema inmunológico de las mujeres y los hombres responde al Covid-19.
Las causas para ello son las diferencias en la expresión genética y hormonal frente a la producción de mediadores químicos intercelulares (citoquinas); activación de células del sistema inmune y expresión de receptores o su señalización.
Takahashi et al, en un estudio realizado entre Marzo 18 y Mayo 9 de 2020, en el Hospital Yale-New Haven, encontró que los pacientes masculinos tenían niveles plasmáticos más altos de citocinas y quimiocinas inmunes innatas, incluidas IL-8, IL-18 y CCL5, junto con una inducción más sólida de monocitos no clásicos.
En contraste, las pacientes femeninas presentaron una activación de células T significativamente más robusta que los pacientes masculinos durante la infección por SARS-CoV-2, que se mantuvo en la vejez.
Ellos encontraron que una respuesta deficiente de las células T se correlacionó negativamente con la edad de los pacientes y fue predictiva de un peor resultado de la enfermedad en los pacientes masculinos, pero no en las mujeres.
En el estudio liderado por Zeng, et al. se pudo observar que el nivel de anticuerpos IgG en pacientes mujeres en estado grave tendía a ser más alto y en la fase temprana de la enfermedad, en comparación con los hombres.
En todas las especies, las hembras tienden a desarrollar una respuesta inmune innata y adaptativa más fuerte a los contagios. Desde un punto de vista evolutivo, esto aumenta la capacidad reproductiva de una especie, ya que las madres tienen más probabilidades de sobrevivir y cuidar a sus crías. Curiosamente, la responsabilidad parental está asociada con una mayor capacidad inmunológica más allá del sexo femenino.
Pero, hay que analizar el papel de las citocinas, en especial por los niveles que poseen los hombres. Las citosinas son mediadores químicos producidos por los linfocitos, macrófagos y otras células como método de comunicación intercelular.
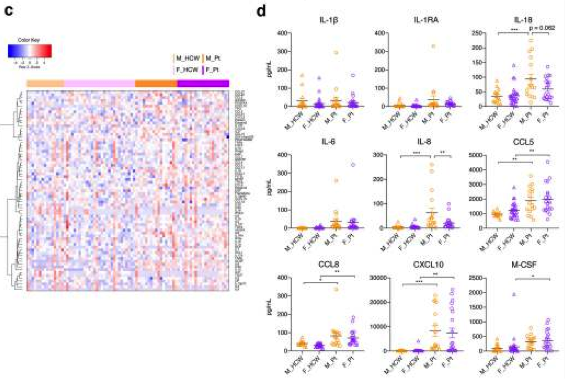
En el trabajo liderado por Takahashi et al, ellos encontraron que los niveles de muchas citocinas y quimiocinas, como IL-6, CXCL10 (IP-10), CCL5 (RANTES), CCL8, se regularon al alza tanto en hombres como en mujeres, y los niveles entre sexos fueron comparables. La IL 8 e IL 18 más elevadas en Varones vs. Mujeres, precozmente y ya en fase de recuperación los niveles de CCL5 y de CXCL10. Estos datos indicaron que las citocinas y quimiocinas inflamatorias innatas se elevan de manera más sólida al comienzo y durante el curso de la enfermedad en pacientes masculinos que en pacientes femeninas.
¿Qué pueden desatar las citocinas en la respuesta al covid-19? Una respuesta inmunológica típica implica la producción de citosinas, que orquestan la diferenciación de linfocitos en función del tipo de patógeno que se elimina. Finalmente, el sistema inmunitario se autorregula y se apaga una vez que se resuelve la infección. Sin embargo, en algunos casos, la respuesta inmunitaria no se detiene, y se produce una sobreproducción de citoquinas inflamatorias que causan daño sistémico a las células huésped.
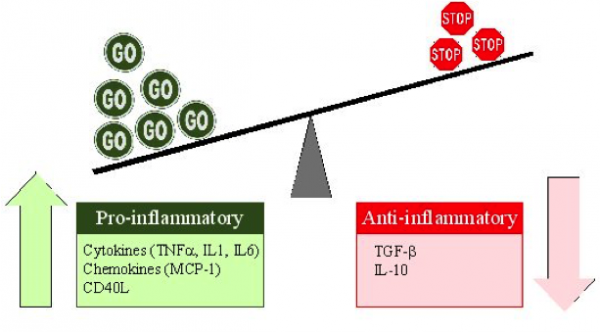
La llamada “tormenta de citoquinas” o síndrome de liberación de citocinas (CRS) se caracteriza por una respuesta pro-inflamatoria agresiva en combinación con una respuesta anti-inflamatoria insuficiente, lo que acaba resultando en la pérdida de la homeostasis de la respuesta inmunitaria. Los factores clave identificados en la patología de una tormenta de citocinas son: TNF alfa, interferones, IL-1 beta, MCP-1 (CCL2) y, la más importante, IL-6.
En el caso de las mujeres, los investigadores hallaron que tenían una activación “más robusta” que los hombres de las células T ¿qué son y cómo actúan en el organismo?
Takahasi et al. observaron una inducción más robusta de linfocitos T activados positivos para CD38 y HLA-DR en pacientes femeninas en comparación con pacientes masculinos. Paralelamente, las células T diferenciadas (positivas para PD-1 y TIM-3) fueron inducidas de manera más robusta en pacientes femeninas en comparación con pacientes masculinos. Estos hallazgos se observaron tanto en células T CD4 como CD8, pero las diferencias fueron más exageradas en las células T CD8.
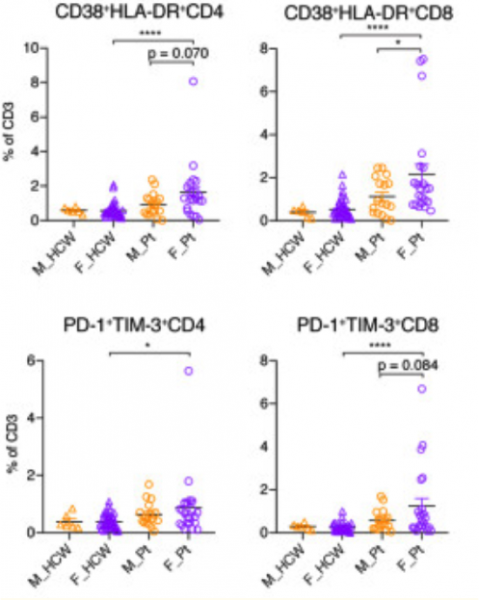
es madPor tanto, las pacientes con COVID-19 mujeres tenían una población de células T activadas y diferenciadas terminalmente más abundante que los pacientes masculinos al inicio del estudio.
No diría que el sistema inmunológico de las mujeres es más fuerte que el de los hombres, sino distinto. Por ejemplo, en la producción temprana de Interferón alfa por las células dendríticas plasmocitoides, mediada por TLR7, que interviene en el reconocimiento temprano de las partículas virales tipo ssRNA, como las del coronavirus. La producción temprana de IFN alfa/beta se ha visto que cuando es precoz tiene una función protectora mientras que si es tardía es deletérea.
Esta activación de las células dendríticas y del TLR7 es mayor y es mejor en las mujeres, ya que su lugar de codificación es en cromosoma X, que como sabemos, es doble en las mujeres. Por tanto ellas, son capaces de evitar la inhibición de la vía de señalización del TLR7 dentro de la célula dendrítica; y producir más cantidades de IFN precozmente.
También tienen menor expresión de IL18 que es una citocina que atrae a los Neutrófilos, así como mayor expresión de Monocitos, int; esto en otras palabras hace que a diferencia de los varones, el daño pulmonar sea menor y por tanto la mortalidad en las mujeres.
Sin embargo, ¿qué tan resistentes son las mujeres a ciertas enfermedades infecciosas? Los datos epidemiológicos indican que la prevalencia de hepatitis A y tuberculosis es significativamente mayor en hombres que en mujeres. Además, las cargas virales son consistentemente más altas en pacientes masculinos con el virus de la hepatitis C (VHC) y el virus de la inmunodeficiencia humana (VIH). Por el contrario, las mujeres desarrollan una respuesta inmunitaria más sólida a las vacunas. Estos hallazgos sugieren colectivamente una capacidad más sólida entre las mujeres para controlar los agentes infecciosos.
Takahashi et al. En el caso particular del SARS COVID 2, las mujeres exhiben una mayor activación y diferenciación de células T (CD38 y HLA-DR), esta población de células exhiben altas funciones efectoras, como proliferación, citotoxicidad y producción de citocinas, y esta subpoblación de células T CD8 + activadas desempeña una función importante durante las infecciones virales agudas, contribuyendo al control viral. La base de esta diferencia se ha atribuido, al menos en parte, al hecho de que muchos genes anti-virales o genes inflamatorios tienen elementos de respuesta estrogénica (ERE) en sus regiones promotoras.
En ese sentido se necesitan diferentes estrategias para garantizar que los tratamientos y las vacunas sean igualmente efectivos tanto para mujeres, como para hombres. Los datos sugieren colectivamente que el panorama inmunológico en los pacientes con COVID-19 es considerablemente diferente entre los sexos. Las vacunas y las terapias para elevar la respuesta inmune de las células T al SARS-CoV-2 podrían estar justificadas para los pacientes masculinos, mientras que las pacientes femeninas podrían beneficiarse de las terapias que amortiguan la activación inmune innata temprana durante la enfermedad.
Las mujeres generalmente viven más que los hombres, en promedio de seis a ocho años. Esta diferencia se debe en parte a una ventaja biológica inherente para la mujer, pero también refleja diferencias de comportamiento entre hombres y mujeres.
Las niñas recién nacidas tienen más probabilidades de sobrevivir hasta su primer cumpleaños que los niños recién nacidos. Esta ventaja continúa durante toda la vida: las mujeres tienden a tener tasas de mortalidad más bajas a todas las edades. La ventaja de la longevidad de las mujeres se hace más evidente en la vejez. Esto puede ser el resultado de comportamientos de menor riesgo de por vida, como fumar y consumir alcohol. Alternativamente, puede ser el efecto de ventajas biológicas más difíciles de identificar que resulten en tasas relativamente más bajas de enfermedades cardiovasculares y cáncer en las mujeres.
La brecha en la esperanza de vida entre mujeres y hombres se está reduciendo en cierta medida en algunos países desarrollados. Esto puede deberse al aumento del tabaquismo entre las mujeres y al descenso de las tasas de enfermedad cardiovascular entre los hombres. También es importante señalar que los años extra de vida de las mujeres no siempre se viven con buena salud.
Bibliografía:
Takahashi T, Wong P, Ellingson M, et al. Sex differences in immune responses to SARS-CoV-2 that underlie disease outcomes. Preprint. medRxiv. 2020;2020.06.06.20123414. Published 2020 Jun 9. doi:10.1101/2020.06.06.20123414
Fanfan Zeng, Chan Dai, Pengcheng Cai, Jinbiao Wang, Lei Xu, Jianyu Li, Guoyun Hu, Lin Wang. medRxiv 2020.03.26.20040709; doi: https://doi.org/10.1101/2020.03.26.20040709
Klein S. L. & Flanagan K. L. Sex differences in immune responses. Nat Rev Immunol 16, 626–638, doi:10.1038/nri.2016.90 (2016).
Fischer J., Jung N., Robinson N. & Lehmann C. Sex differences in immune responses to infectious diseases. Infection 43, 399–403, doi:10.1007/s15010-015-0791-9 (2015).
Guerra-Silveira F. & Abad-Franch F. Sex bias in infectious disease epidemiology: patterns and processes. PLoS One 8, e62390, doi:10.1371/journal.pone.0062390 (2013).
David R. Are men and women different? Nat Rev Immunol. (2009) 9:605–605. Doi: 10.1038/nri2631
Li S-W, Wang C-Y, Jou Y-J, Huang S-H, Hsiao L-H, Wan L, et al. SARS Coronavirus papain-like protease Inhibits the TLR7 signaling pathway through removing Lys63-linked polyubiquitination of TRAF3 and TRAF6. Int J Mol Sci. (2016) 17:678. Doi: 10.3390/ijms17050678
Souyris M, Mejía JE, Chaumeil J, Guéry J-C. Female predisposition to TLR7-driven autoimmunity: gene dosage and the escape from X chromosome inactivation. Semin Immunopathol. (2019) 41:153–64. Doi: 10.1007/s00281-018-0712-y
Takahashi T, Wong P, Ellingson M, et al. Sex differences in immune responses to SARS-CoV-2 that underlie disease outcomes. Preprint. medRxiv. 2020;2020.06.06.20123414. Published 2020 Jun 9. doi:10.1101/2020.06.06.20123414
Hewagama A, Patel D, Yarlagadda S, Strickland FM, Richardson BC. Stronger inflammatory/cytotoxic T-cell response in women identified by microarray analysis. Genes Immun. 2009 Jul;10(5):509-16. doi: 10.1038/gene.2009.12. Epub 2009 Mar 12. PMID: 19279650; PMCID: PMC2735332.
https://ourworldindata.org/why-do-women-live-longer-than-men
¿Ya conoces nuestro canal de YouTube? ¡Suscríbete!













San Pedro, ¡¡¡Por favor!!!
Proactividad en la Electricidad y Conectividad Digital -una necesidad urgente-
Mitos y verdades de la Consulta popular
La UTPL coincide en la importancia de parques científicos y tecnológicos para la innovación
Prevención de desastres: Conozca el mapa de eventos morfoclimáticos de Quito